Les conséquences différées du déficit énergétique sur la reproduction
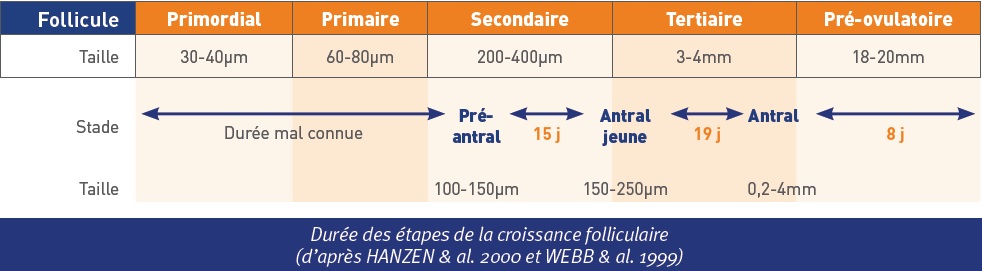
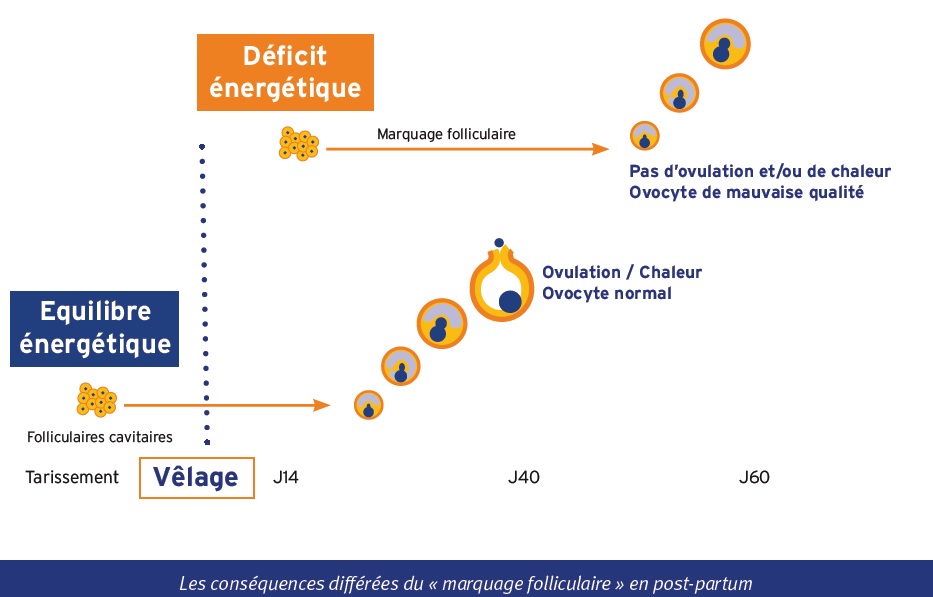
En post partum, le déficit énergétique prononcé peut altérer précocement les follicules ovariens en cours d’évolution, à un stade où ils acquièrent leur sensibilité à la FSH et à la LH. Ce phénomène communément appelé « marquage folliculaire » concernerait les follicules cavitaires en début d’évolution (= follicules antraux = follicules tertiaires). Au cours de la folliculogenèse, ces stades cavitaires précoces apparaissent environ 1.5 mois avant le stade ovulatoire terminal. Chez la vache, il faut en effet 42 jours pour qu’un tout jeune follicule cavitaire de 0.13 mm atteigne la taille pré-ovulatoire) ; d’où le décalage observé sur le terrain entre le nadir du déficit énergétique (son point le plus négatif) et sa conséquence défavorable sur la fertilité.
Le « marquage » des jeunes follicules en situation de « stress nutritionnel » serait provoqué directement par le déficit énergétique et/ou indirectement par l’action négative des acides gras non estérifiés (AGNE), libérés à partir des graisses corporelles pour compenser le déficit énergétique.
Les conséquences différées du marquage folliculaire peuvent être :
- la non expression des chaleurs, en relation avec la production de follicules ovulatoires de plus petite taille, produisant moins d’œstrogènes,
- l’absence d’ovulation (anovulation) ou une ovulation anormale (dysovulation), associées à un pic de LH préovulatoire de moindre amplitude ou bien décalé,
- une dégradation de la fertilité (si un comportement de chaleurs peut tout de même être observé) consécutive soit au développement anormal des ovocytes contenus dans les follicules « marqués », soit au pic ovulatoire défaillant (suffisant pour l’ovulation mais avec des répercussions défavorables sur la mise en place du corps jaune de gestation).

Ce mécanisme de « marquage folliculaire » permet d’expliquer l’observation classiquement rapportée par les éleveurs : les vaches extériorisent assez régulièrement une première chaleur vers 30-40 jours post partum (trop tôt pour que la vache soit inséminée) mais l’œstrus suivant attendu vers 60 jours pp n’est pas observé (alors que la vache pourrait être inséminée). En pratique, l’œstrus observé vers 1 mois après vêlage correspond à l’ovulation d’un follicule qui a traversé le stade critique de son évolution pendant le tarissement, donc à une période sans déficit énergétique. A l’opposé, les ovulations vers 2 mois après vêlage correspondent à des follicules dont l’évolution
était à un stade critique dans les 15 premiers jours après vêlage, période au cours de laquelle le déficit énergétique est le plus marqué en général.
En pratique
L’absence de chaleurs 2 mois après vêlage concerne particulièrement les VLHP dont le pic de déficit énergétique est souvent très marqué en post partum. Il est recommandé de ne pas mettre à la reproduction trop tôt ces femelles fortes productrices qui, même vues en chaleurs, peuvent présenter des ovocytes de qualité insuffisante et donc une fertilité médiocre. Les traitements hormonaux sont sans effet sur le « marquage » folliculaire. La seule solution consiste à attendre une nouvelle génération de follicules dont le développement a débuté après la période de déficit énergétique ; ce qui n’est pas favorable à la fécondité !
C’est le même type de mécanisme qui explique les effets différés de la canicule sur la fertilité. Le stress thermique affecte les stades précoces de la folliculogenèse, avec pour conséquence, plusieurs semaines plus tard, la réduction de la production d’œstrogènes par le follicule et le développement anormal de l’ovocyte.
ENJALBERT F. Journées nationales des GTV Tours 1998. 49-55.
ENJALBERT F. Journées nationales des GTV Nantes 2008. 195-199.
ROTH & al. Reproduction 2001. 121 : 745-751.
ROTH & al. Reproduction 2001. 122 : 737-744.
HANZEN C. & al. Annales de Médecine Vétérinaire 2000. 144 : 223-235.
LUSSIER J. & al. Journal of reproduction and Fertility 1987. 81 : 301-307.
DOBSON H. & al. Reproduction in Domestic Animals 2007. 42 (suppl. 2) : 17-23.
WATHES D. C. & al. Reproduction 2003 (suppl.). 61 :1-19.

